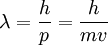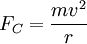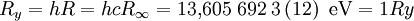Die Rydberg-Konstante ist eine nach Johannes Rydberg benannte Naturkonstante. Sie tritt in der Rydberg-Formel auf, einer Näherungsformel zur Berechnung von Atomspektren. Ihr Wert ist die als Wellenzahl ausgedrückte Ionisierungsenergie des Wasserstoffatoms unter Vernachlässigung relativistischer Effekte und der Mitbewegung des Kerns (also bei unendlicher Kernmasse, daher der Index ).
Der derzeit empfohlene Wert der Rydberg-Konstante beträgt:
Die relative Standardunsicherheit beträgt 1,9 · 10−12.
Zusammenhang mit anderen Naturkonstanten
Die Rydberg-Konstante ist mit der Feinstrukturkonstante α, dem bohrschen Radius a0 und der Compton-Wellenlänge λC,e des Elektrons wie folgt verknüpft:
Hierbei ist
- die Masse des Elektrons,
- die Lichtgeschwindigkeit,
- die Planck-Konstante,
- die Elementarladung,
- die elektrischen Feldkonstante.
Rydberg-Frequenz und Rydberg-Energie
Die Rydberg-Konstante wird häufig auch als Frequenz oder als Energie angegeben. Die empfohlenen Werte betragen:
- Rydberg-Frequenz:
- Rydberg-Energie:
Der konkrete Wert der Rydberg-Energie wird als Maßeinheit für Energien verwendbar.
Herleitung
Eine erste Herleitung der Rydberg-Konstante konnte im Rahmen des Bohrschen Atommodells gegeben werden. Eine modernere Herleitung im Rahmen der Quantenmechanik findet sich im Wasserstoffproblem.
In beiden Fällen gelangt man zu einer Formel für die quantisierten Energieniveaus des Wasserstoffatoms von der Form:
Aus der Differenz zweier Energieniveaus
lässt sich mit
die Wellenzahl des bei einem solchen Übergang emittierten oder absorbierten Lichtes bestimmen zu
Der Vergleich mit der Rydberg-Formel zeigt, unter der Annahme eines unendlich schweren Wasserstoffkerns, dass die Rydberg-Konstante gegeben ist durch
Daraus ergibt sich auch, dass die Rydberg-Konstante die Wellenzahl (inverse Wellenlänge) eines Photons ist, dessen Energie der Ionisierungsenergie des Wasserstoffatoms entspricht.
Weblinks
Einzelnachweise